编 者 按
近日,清华大学精密仪器系尤政教授团队提出了基于点阵激光激发方法的高通量流式成像方法。该方法可实现低成本、高可扩展性的成像流式细胞仪,而且首次验证了全光谱成像流式技术。相关成果以“Imaging flow cytometry using linear array spot excitation”为题在期刊《Device》上发表,并被选为当期封面文章。

研究背景与成果
流式和显微镜是细胞检测的两个基本工具。流式技术具有高通量和丰富的分子检测信息,但缺乏细胞形态信息;相反,荧光显微镜可以提供细胞影像信息,但检测通量低,难以获取足够的样本数据进行统计分析。自流式细胞仪问世以来,其发展趋势一直在于保持高检测通量的同时增加更多信息维度,例如空间形态信息或光谱信息,以实现更准确的细胞分析或分选。成像流式技术是一种整合了流式细胞仪高检测通量和荧光显微镜空间分辨能力的仪器。然而,由于成像通量、分辨率和检测灵敏度之间的基本矛盾,现有的成像流式技术通常采用复杂的光路系统、复杂的图像重构算法,同时成像可扩展性也很有限。这使得成像流式细胞仪难以达到像传统流式细胞仪那样的高检测通道数,并且其高昂的技术成本限制了应用范围。
为解决这些问题,清华大学精仪系尤政教授课题组提出了一种基于点阵激光激发的成像方法,即Linear spot array excitation(LASE)。该方法的核心思想是使用点阵结构光斑替代传统流式细胞仪中的椭圆或条状光斑,从而赋予流式细胞仪成像能力。

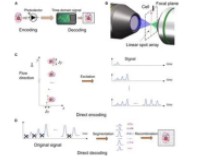
图1:点阵激光激发成像原理示意图
图1展示了该成像方法的工作原理。在检测区域中,激发光斑呈一串等间隔的点阵光斑,由衍射光学器件生成,光斑间隔大于细胞大小,并且其排列直线与细胞运动直线呈一定的小角度。当细胞依次通过照明光斑时,将产生一串荧光和散射光信号。在图像重构阶段,只需通过信号的分割和重组即可重建细胞图像。该方法具有实现简单、实时重建的优势,并且与现有流式细胞仪光路结构兼容,因此具有良好的可扩展性,能够在高检测通量的基础上,同时实现多激光、多荧光通道以及无标记成像。
技术成果展示

图2. 双激光五通道成像流式系统

图3.细胞器进行成像与细胞周期研究
本研究利用基于LASE成像方法构建了一个成像系统,具备2色激光(488nm/638nm)和5个成像通道(明场、FITC、PE、PI、APC),如图2A所示。该系统经验证在30×30μm的成像视场下,具有1.3μm的空间分辨率。当细胞样本以5m/s的流速经过探测区域后,系统能够进行无标记的明场成像和荧光成像,且不会出现运动模糊,成像通量最高可达每秒5000个细胞每秒。该系统不仅能够对细胞中的细胞器结构进行成像(见图3A),而且可以在多个荧光波段下,实现对不同细胞结构的同时成像(见图3B)。在生物学应用中,图像被广泛视为金标准,因为它能够为细胞分析提供更为丰富和准确的信息,从而更细致准确地进行细胞分型。举例来说,通过图像,可以在传统流式基础上更进一步区分细胞周期M期的细胞核形态,如图3C所示。

图4. 32通道全光谱成像流式验证
得益于LASE成像方法的高度可扩展性,本论文将成像荧光信号引入一个基于棱镜色散的32通道光谱仪中,初步验证了全光谱成像流式细胞仪的可行性。该系统在保持每秒5000个细胞的检测速度通量的同时,能够同时在32个光谱通道上对细胞进行成像。借助光谱分解算法,可以有效解决多染料检测实验中染料光谱混叠效应的问题,将成像流式细胞仪的理论可检测染料数扩展至30以上的量级。这将大大提高成像流式细胞仪给单细胞分析带来的信息量。
成果优势
该研究提出的点阵激光激发的成像方法,具有以下优势: