基因编码的荧光传感器可以在单细胞水平追踪代谢物、蛋白质或重金属离子等细胞内靶标的丰度变化和动力学分布,并解析活细胞的生理过程和信号传导通路。7月24日,《核酸研究》(Nucleic Acids Research)在线发表了中国科学院北京生命科学研究院李幸团队撰写的题为Genetically encoded RNA-based sensors with Pepper fluorogenic aptamer的研究论文。该团队开发了一类基因编码的新型荧光RNA传感器。该传感器能够在活细胞中监测代谢物、外源药物、蛋白与金属离子等靶标,展现出高通量、高内涵药物筛选的潜力。
传统的基因编码传感器由荧光蛋白和结合靶标的蛋白模块组成。然而,由于多数靶标缺乏对应的蛋白模块,科学家难以构建基于荧光蛋白的传感器。此外,基于荧光蛋白的传感器还有信噪比低等缺陷,限制了荧光蛋白传感器的应用。
近年来,基于荧光RNA的传感器发展迅速。荧光RNA传感器由荧光RNA与结合靶标的RNA模块组成。二者通过一个短茎连接。该短茎称为传导模块(transducer module),其热力学稳定性由靶标识别适配体调节。靶标与结合靶标的RNA模块结合,诱导RNA构象变化,调控荧光RNA适配体的荧光强度,从而检测靶标信号,解析其在活细胞中的信号通路。然而,这些荧光RNA传感器通常含有RNA G四链体(RG4)结构。RG4结构可被活细胞解旋酶靶向,导致RNA的解旋或降解,故限制了含RG4的荧光RNA传感器在活细胞中的应用。
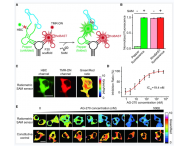
为此,李幸团队通过系列实验设计,研发了不包括RG4的荧光RNA传感器。研究选择使用了Pepper荧光适配体。Pepper不含RG4结构,避免了被细胞酶降解或解旋。此外,Pepper亮度高、稳定性强,并能够结合不同小分子探针产生不同颜色的荧光。基于此,李幸团队开发了一系列基于Pepper的生物传感器。进一步,实验表明这些传感器不包含RG4结构,并可以高效监测活细胞中的内源小分子代谢物、外源药物、蛋白质和金属离子等多种靶标。该研究发展的基于RNA传感器率先用于检测人体细胞内的金属离子,为探索人体活细胞金属离子提供了新型基因编码工具(图1)。
该团队基于Pepper的生物传感器,探讨了甲基化代谢物S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)代谢通路,测定了靶标药物活性。研究将Pepper与SAM适配体融合,构建出低背景、高响应、高选择性的SAM传感器。进一步,该工作探究了单细胞中SAM合成的代谢来源,解析了SAM合成酶(methionine adenosyltransferase,MATase)的酶活性和基因表达水平。此外,该工作还构建了监测SAM的比率传感器。该传感器精确定量了MATase的酶活性,并准确测定了MATase抑制剂AG-270的半抑制浓度(IC50)。该工作首次发展荧光RNA传感器来准确测定活细胞中的药物IC50,为研发基于RNA的药物筛选平台验证了可行性,并提供了高效的MATase酶药物筛选工具(图2)。
该团队为追踪活细胞内靶标及其信号传导途径提供了高效的生物传感平台,在药物筛选和疾病诊断等领域具有潜在的应用价值。研究工作得到国家自然科学基金等的支持。
论文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad620/7230091?login=false

图1. 将Pepper改造为高性能荧光RNA传感器,检测细胞内靶标,监测细胞甲基化代谢通路与药物活性

图2. 构建基于Pepper的比率传感器,准确测定MATase抑制剂AG-270的半抑制浓度(IC50)